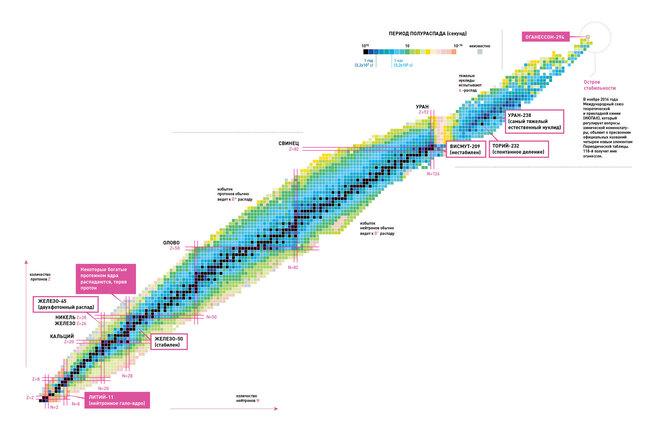
Límites de la tabla periódica de elementos. ¿Dónde está la feliz isla de la estabilidad?
¿La tabla periódica de elementos tiene un límite "superior"? Entonces, ¿hay un número atómico teórico para un elemento superpesado que sería imposible de alcanzar en el mundo físico conocido? El físico ruso Yuri Oganesyan, que da nombre al elemento 118, cree que tal límite debe existir.
Según Oganesyan, jefe del laboratorio Flerov del Instituto Conjunto de Investigación Nuclear (JINR) en Dubna, Rusia, la existencia de tal límite es el resultado de efectos relativistas. A medida que aumenta el número atómico, aumenta la carga positiva del núcleo, y esto, a su vez, aumenta la velocidad de los electrones alrededor del núcleo, acercándose al límite de velocidad de la luz, explica el físico en una entrevista publicada en la edición de abril de la revista. . Científico nuevo. “Por ejemplo, los electrones más cercanos al núcleo en el elemento 112 viajan a 7/10 de la velocidad de la luz. Si los electrones exteriores se acercaran a la velocidad de la luz, cambiarían las propiedades del átomo, violando los principios de la tabla periódica”, dice.
Crear nuevos elementos superpesados en laboratorios de física es una tarea tediosa. Los científicos deben, con la máxima precisión, equilibrar las fuerzas de atracción y repulsión entre las partículas elementales. Lo que se necesita es un número "mágico" de protones y neutrones que se "junten" en el núcleo con el número atómico deseado. El proceso en sí acelera las partículas a una décima parte de la velocidad de la luz. Hay una probabilidad pequeña, pero no nula, de que se forme un núcleo atómico superpesado del número requerido. Luego, la tarea de los físicos es enfriarlo lo más rápido posible y "atraparlo" en el detector antes de que se desintegre. Sin embargo, para esto es necesario obtener las "materias primas" apropiadas: isótopos de elementos raros y extremadamente caros con los recursos de neutrones requeridos.
Esencialmente, cuanto más pesado es un elemento en el grupo de las transactínidas, más corta es su vida. El elemento con número atómico 112 tiene una vida media de 29 segundos, 116 - 60 milisegundos, 118 - 0,9 milisegundos. Se cree que la ciencia alcanza los límites de la materia físicamente posible.
Sin embargo, Oganesyan no está de acuerdo. Presenta el punto de vista de que está en el mundo de los elementos superpesados. "Isla de la Estabilidad". “El tiempo de descomposición de los nuevos elementos es extremadamente corto, pero si agregas neutrones a sus núcleos, su vida útil aumentará”, señala. “Añadir ocho neutrones a los elementos numerados 110, 111, 112 e incluso 113 prolonga su vida en 100 años. una vez".
Nombrado en honor a Oganesyan, el elemento Oganesson pertenece al grupo de los transactínidos y tiene el número atómico 118. Fue sintetizado por primera vez en 2002 por un grupo de científicos rusos y estadounidenses del Instituto Conjunto para la Investigación Nuclear en Dubna. En diciembre de 2015, fue reconocido como uno de los cuatro nuevos elementos por el Grupo de Trabajo Conjunto IUPAC/IUPAP (un grupo creado por la Unión Internacional de Química Pura y Aplicada y la Unión Internacional de Física Pura y Aplicada). El nombramiento oficial tuvo lugar el 28 de noviembre de 2016. Oganesson madre número atómico más alto i mayor masa atómica entre todos los elementos conocidos. En 2002-2005, solo se descubrieron cuatro átomos del isótopo 294.
Este elemento pertenece al grupo 18 de la tabla periódica, es decir Gases nobles (siendo su primer representante artificial), sin embargo, puede mostrar una reactividad significativa, a diferencia de todos los demás gases nobles. En el pasado, se pensaba que el oganesson era un gas en condiciones estándar, pero las predicciones actuales apuntan a un estado constante de agregación en estas condiciones debido a los efectos relativistas que Oganessian mencionó en la entrevista citada anteriormente. En la tabla periódica, está en el bloque p, siendo la última raíz del séptimo período.
Tanto los eruditos rusos como los estadounidenses históricamente han propuesto diferentes nombres para él. Al final, sin embargo, la IUPAC decidió honrar la memoria de Hovhannisyan reconociendo su gran contribución al descubrimiento de los elementos más pesados de la tabla periódica. Este elemento es uno de los dos (junto al seaborg) que lleva el nombre de una persona viva.

