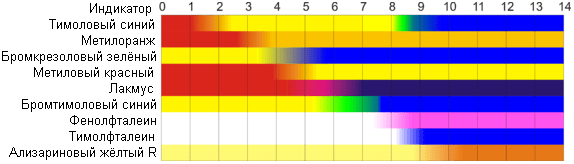
Indicadores de pH naturales
Bajo la influencia de los cambios en la reacción del medio ambiente, no solo los compuestos utilizados en los laboratorios como indicadores adquieren diferentes colores. Un grupo igualmente numeroso está formado por sustancias contenidas en productos naturales. En varios ensayos, probaremos el comportamiento de los indicadores de pH en nuestro entorno.
Para los experimentos, se requerirán varias soluciones con diferentes pH. Se pueden obtener diluyendo ácido clorhídrico con HCl (pH 3-4% solución es 0) y solución de hidróxido de sodio NaOH (4% solución tiene un pH de 14). El agua destilada, que también utilizaremos, tiene un pH de 7 (neutro). En el estudio utilizaremos jugo de remolacha, jugo de col lombarda, jugo de arándanos e infusión de té.
En tubos de ensayo con soluciones preparadas y agua destilada, vierta un poco de jugo de remolacha roja (foto 1). En soluciones ácidas, adquiere un color rojo intenso, en soluciones neutras y alcalinas, el color se vuelve marrón, convirtiéndose en un tinte amarillo (foto 2). El último color es el resultado de la descomposición del tinte en un ambiente fuertemente alcalino. La sustancia responsable de la decoloración del jugo de remolacha es la betanina. La acidificación del borscht o de la ensalada de remolacha es un “chip” culinario que le da al plato un color apetitoso.
De la misma manera, pruebe el jugo de col roja (foto 3). En una solución ácida, el jugo se vuelve de color rojo brillante, en una solución neutra se vuelve de color púrpura claro y en una solución alcalina se vuelve verde. También en este caso, una base fuerte descompone el tinte: el líquido en el tubo de ensayo se vuelve amarillo (foto 4). Las sustancias que cambian de color son las antocianinas. Rociar la ensalada de repollo rojo con jugo de limón le da un aspecto atractivo.
Otro experimento requiere jugo de arándanos (foto 5). El color rojo violeta cambia a rojo en medio ácido, a verde en medio alcalino y a amarillo en medio fuertemente alcalino (descomposición del tinte) (foto 6). Aquí, también, las antocianinas son responsables de cambiar el color del jugo.
La infusión de té también se puede utilizar como indicador de pH de la solución (foto 7). En presencia de ácidos, el color se vuelve amarillo pajizo, en medio neutro se torna marrón claro y en medio alcalino se vuelve marrón oscuro (foto 8). Los derivados del tanino son los encargados de cambiar el color de la infusión, dando al té su característico sabor agrio. La adición de jugo de limón hace que el color de la infusión sea más claro.
También vale la pena realizar pruebas de forma independiente con otros indicadores naturales: muchos jugos y decocciones de plantas cambian de color debido a la acidificación o alcalinización del medio ambiente.
Véalo en vídeo:
Indicadores de pH naturales
